こんにちはプログレです。
本日は2024年1月15日に発出された医薬品(薬物)の治験中副作用等報告制度として以下の通知が発出されましたので、その中身を紹介します。
「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告について」の一部改正について
今回の変更点
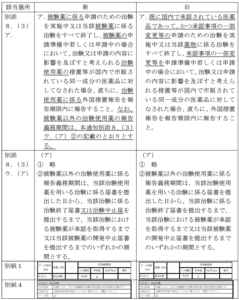
一番のメインは
「別添 8.(3)ア.」
変更点を分かりやすく説明すると…
2022年に大規模な薬機法の改正がありました。
その時に「治験使用薬」という概念が定義されました。
その治験使用薬に関する措置について追記がなされました。
詳しくは、治験使用薬(例えば海外から輸入する場合)の措置等が国内で市販されている同一成分の医薬品に対してなされる場合にも、治験使用薬にかかる外国措置報告を行う
ということがここで規定されております。
つまり日本で発行されている添付文書改訂が外国措置報告として該当する場合、措置報告を実施する必要があるということが規定されました

具体的にどのようなプロセスにすべき?
PMDAメディナビから添付文書改訂の情報を入手
各々の会社で対象としている治験使用薬等をスクリーニングして判断する
あとがき
今考えても改正薬機法は、めちゃくちゃインパクトの大きな変更であったと
同時主担当として対応しながら感じます。
主担当でなくても大なり小なりの業務へのインパクトはあったのではないかと。
当時は正解がわからず、とりあえず設定していました。
問題は完了してリリースした後。
その時のベンダーさんやIT担当者がとても優秀だったので乗り越えられたと、
今でも思い出してしみじみします


コメント