こんにちはプログレです。
今日は、医薬品の申請準備〜承認内で使用するeCDTについて分かりやすく説明します。
筆者は製薬業界12年以上勤務をしており、今は管理職に就いています。
小さな会社なので、守備範囲も広く、毎日新しいことにチャレンジしてながら、フルタイムで働き2歳と4歳の子育てをしています。
医薬品の申請準備〜承認はこちらの過去記事でプロセスをご覧いただけます。
【誰でも分かる承認されるまでのプロセス】医療用医薬品の承認の流れ【製薬会社で働く私が解説】
【小学生でも分かる】医療用医薬品の承認の流れ(詳細)【製薬会社で働く私が解説】
eCTDとは
Electronic common technical documentの略
新医薬品の製造又は輸入の承認申請時に承認申請書に添付すべき資料。
日本、アメリカ、EU共通の国際共通化資料。
ICH(医薬品規制調査国際会議)で作成方法を決めている。
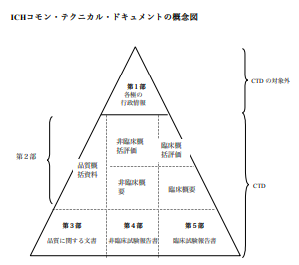
構成
・第1部(モジュール1):申請書等行政情報及び添付文書に関する情報
・第2部(モジュール2):CTDの概要(サマリー)
・第3部(モジュール3):品質に関する文書
・第4部(モジュール4):非臨床試験報告書
・第5部(モジュール5):臨床試験報告書
*画像をクリックすると情報元である「医薬品の承認申請のための 国際共通化資料 コモン・テクニカル・ドキュメント(CTD)の構成」に移動します。
もっと具体的な構成
| CTD番号 | 内容 | 関連するその他の資料 |
| M1.11 | RMP(案) | 一般使用成績調査(案) 適正使用ガイド(案) 患者向け資材(案) |
| M1.8.1 | 添付文書(案) | ー |
| M1.8.2 | 効能効果(案) | ー |
| M1.8.3 | 用法用量(案) | ー |
| M1.8.4 | 使用上の注意(案) | ー |
| M2.5 | 医薬品に関する考察・解釈 | ー |
| M2.7 | 個別試験の要約、複数試験の分析 | ー |
| M5 | ・CSR、治験総括報告書(付録:Protocol) ・その他の報告書 ・患者一覧 |
ー |

なんとなくイメージはついたけど、もっと具体的に分かりやすく書けないの?
「コモン・テクニカル・ドキュメント(CTD)の構成」に対するQ&A にこのような記載がありました。
Q1.書式又は内容
CTD様式(第2部から第5部)による申請資料はすべての極で同一でなければならないか?
A1.必ずしも同一であるとは限らない。
CTDはICH3極の規制当局へ情報を提出するための共通の様式を示している。しかしながら、CTDは申請資料の内容について述べたものではない。各極ごとに、多くの要求事項があり、また、申請者の好みなどもあって、そういうことが各極で提出される申請資料の内容に影響を及ぼすものと考えられる。
参照元:https://www.pmda.go.jp/files/000156609.pdf
つまり、規制当局と申請者の好みによりまた申請する薬によっても構成が変わってくることを意図しています。



コメント