こちらの記事では、「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&Aの改正について」例示を用いて説明します。
分かりやすい言葉で説明します。
筆者情報
製薬業界12年以上勤務をしており、今は管理職に就いています。
小さな会社なので、守備範囲も広く、毎日新しいことにチャレンジしてながら、フルタイムで働き2歳と4歳の子育てをしています。
解説する通知
令和2年12月9日
事務連絡
「E2B(R3)実装ガイドに対応した市販後副作用等報告及び 治験副作用等報告に関する Q&A の改正について 」
・医薬品副作用全ての通知はこちらのPMDAサイトからチェック可
副作用等の報告に関する情報
表の見方
【市販後】:市販後副作用報告に関係する内容
【治験】:治験副作用報告に関係する内容
Q&A詳細
| Q26:【治験】 二重盲検比較試験の開鍵後、被験薬以外の治験使用薬によるものであると判明し、 被験薬について、当該症例以外に同じ副作用の情報を入手していない場合には、当該副作用は治験薬概要書から予測できないものとして扱うのか? | A26:【治験】 貴見のとおり。 |
補足:治験使用薬とは
▶︎治験実施計画書において被験薬の有効性及び安全性の評価に使用することを規定された被験薬、対照薬、併用薬、レスキュー薬、前投与薬等を指す。なお、治験使用薬は、その有効成分の国内外での 承認の有無は問わない。(関連通知:治験の依頼をしようとする者による薬物に係る治験の計画の 届出等に関する取扱いについて)
▶︎治験実施計画書において被験薬の有効性及び安全性の評価に使用することを規定された被験薬、対照薬、併用薬、レスキュー薬、前投与薬等を指す。なお、治験使用薬は、その有効成分の国内外での 承認の有無は問わない。(関連通知:治験の依頼をしようとする者による薬物に係る治験の計画の 届出等に関する取扱いについて)
| Q27:【治験】E2B(R3)二課長通知別添8.(1)エ及びカについて、治験依頼者と承認申請を行う製造販売業者が異なり、治験依頼者が申請資料概要を入手できない場合においては、治験依頼者からの副作用等報告の予測性判断の根拠として治験薬概要書を用いてもよいか? | A27:【治験】 差し支えない。 |
補足:この質問の背景は、製造販売業者が承認申請をしている真っ最中である、申請資料(添付文書など)を手に入れられない
| Q28:【治験】 被験薬以外の治験使用薬の副作用等報告において、「科学的知見を記載した文書」 は治験使用薬ごとに治験依頼者が選択してよいか? | A28:【治験】 よい。 |
補足:治験届を提出する際に「科学的知見を記載した文書」が必要だと考える(治験使用薬の定義で治験届を提出したら更新します…)
(4)重篤性の判断基準
| Q29:【市販後】 副作用が生じたとの情報を入手したが、重篤性を評価できる情報が得られない場合は、どのように対処したらよいか? | A29:【市販後】 重篤性の評価ができるよう、詳細情報の収集に努め、入手できた情報から、生じた副作用ごとに、その重篤性を評価すること。 |
補足:報告者が重篤度基準を設定していなくても、製薬企業は副作用によって重篤/非重篤と出来るリストを持っている(例:発熱が38.0℃以上なら重篤など)
| Q30:【市販後】【治験】 ICH における副作用の重篤の定義との関連はどのように考えればよいか? | A30:【市販後】【治験】 次の表を参考とすること。 |
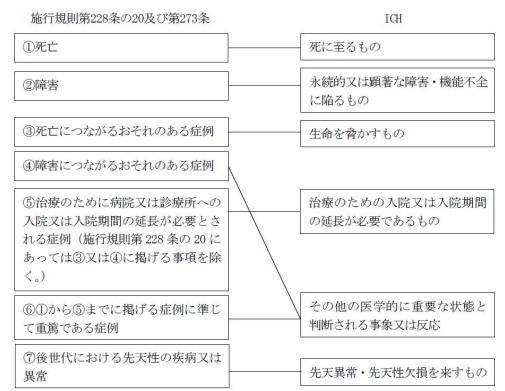
補足:施行規則で「○○につながるおそれ」▶︎「その他の医学的に重要」


コメント