こちらの記事では、「E2B(R3)実装ガイドに対応した市販後副作用等報告及び治験副作用等報告に関するQ&Aの改正について」例示を用いて説明します。
分かりやすい言葉で説明します。
筆者情報
製薬業界12年以上勤務をしており、今は管理職に就いています。
小さな会社なので、守備範囲も広く、毎日新しいことにチャレンジしてながら、フルタイムで働き2歳と4歳の子育てをしています。
解説する通知
令和2年12月9日
事務連絡
「E2B(R3)実装ガイドに対応した市販後副作用等報告及び 治験副作用等報告に関する Q&A の改正について 」
・医薬品副作用全ての通知はこちらのPMDAサイトからチェック可
副作用等の報告に関する情報
表の見方
【市販後】:市販後副作用報告に関係する内容
【治験】:治験副作用報告に関係する内容
Q&A詳細
| Q46:【市販後】 新有効成分含有医薬品の再審査期間中に、効能追加等により新たに市販直後調査を実施する医薬品において、当該市販直後調査の対象となる効能、効果等に係る使用により発生した副作用が市販直後調査終了後に発生した場合、「J2.4.k 新医薬品等の状況区分」は、いずれの状況区分に従って報告すればよいか? | A46:【市販後】 当該症例の発生が、効能追加等の承認から2年以内であれば「承認2年以内」として、効能追加等の承認から2年経過以降であれば「該当なし」として報告すること。 ただし、再審査期間満了後に効能追加等の承認を取得した場合は、当該承認から2年以内であっても「該当なし」として報告すること。 |
補足:新医薬品等の状況区分(J2.4.k)
○ 承認申請の区分に関わらず、市販直後調査期間中に得られた症例は、市販直後調査中として報告すること。なお、承認事項一部変更申請に基づき承認された医薬品において、変更事項が市販直後調査の対象とされた場合には、当該医薬品の使用が市販直後調査の対象とされた変更事項に該当する場合又は該当するか否かが不明の場合、市販直後調査中として報告すること。当該 医薬品の使用が市販直後調査の対象とされた変更事項に該当しない場合は、 新有効成分含有医薬品としての承認に基づく状況区分に従って報告すること。
まとめ▶︎「市販直後調査中」に受領した症例は医薬品がいかなる状況であっても「市販直後調査中」としてPMDA報告すること
○ 承認申請の区分に関わらず、市販直後調査期間中に得られた症例は、市販直後調査中として報告すること。なお、承認事項一部変更申請に基づき承認された医薬品において、変更事項が市販直後調査の対象とされた場合には、当該医薬品の使用が市販直後調査の対象とされた変更事項に該当する場合又は該当するか否かが不明の場合、市販直後調査中として報告すること。当該 医薬品の使用が市販直後調査の対象とされた変更事項に該当しない場合は、 新有効成分含有医薬品としての承認に基づく状況区分に従って報告すること。
まとめ▶︎「市販直後調査中」に受領した症例は医薬品がいかなる状況であっても「市販直後調査中」としてPMDA報告すること
| Q47:【市販後】【治験】 「J2.4.k 新医薬品等の状況区分」や「J2.14.i 未知・既知」などの J 項目で繰り返しを示す記号は、「k」や「i」など使い分けられているのは何故か? | A47:【市販後】【治験】 J 項目中の繰り返し記号は、E2B(R3)項目の繰り返し記号と以下のとおり対応している。また、副作用等情報管理システムは XPath を使って値を取得しているが、XPath によって最初に取得した「G.k」に属する「J2.4.k」が第1回目の繰り返しに該当する。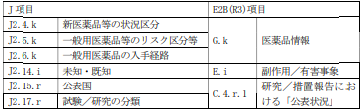 |
| Q48:【市販後】【治験】 一症例中の被疑薬に市販品と治験品目の両方が含まれていた場合、それぞれ該当する 「J2.4.k 新医薬品等の状況区分」を記載することでよいか? | A48:【市販後】【治験】 よい。 |
補足:被疑薬に市販品と治験品目の両方が含まれている場合は、
✅ 市販を第一被疑薬として市販後として報告
✅ 治験を第一被疑薬として治験として報告
| Q49:【治験】下記のような治験使用薬については、「J2.4.k 新医薬品等の状況区分」は何を選択すべきか。 ① 国内既承認の医薬品と同一成分の外国で製造販売されている医薬品(外国医薬品)を被験薬として使用する場合 ② 国内既承認の医薬品と同一成分の外国で製造販売されている医薬品(外国医薬品)を治験使用薬(被験薬を除く)として使用する場合 |
A49:【治験】 ① 「4=一変治験中」を選択すること。 ② 「8=国内既承認(被験薬除く)」を選択すること。 有効成分の国内の承認状況に応じて、被験薬の場合は「3=未承認」及び「4=一変治 験中」、被験薬を除く治験使用薬の場合は「8=国内既承認(被験薬除く)」及び「9= 国内未承認(被験薬除く)」より適切に選択すること。 |
補足:①も②も日本で承認されているけれども、国際治験のため、外国から医薬品を輸入することを意図しています
(7)ICSR 項目
| Q50:【市販後】【治験】 「N.1.5 バッチ伝送の日付」「N.2.r.4 メッセージ作成の日付」「C.1.2 作成の日付」では年月日時分秒を記載するが、ICSR 等ファイルを作成する時刻とそのデータを送信するまでの時刻とでタイムラグが生じる場合にはどうしたらよいか? | A50:【市販後】【治験】 ICSR等ファイルを作成する場合には、「N.2.r.4」と「C.1.2」は完全に一致すること。「N1.5」については「N.2.r.4」等の作成時刻以降の時刻となるように配慮して日付(年月日時分秒)を記載すること。なお、追加報告においては、「C.1.2」の日付が前回の報告と同一の場合はエラーとなるので、必ず前回以降の時刻となるように配慮 して日付を記載すること。 CD等で提出する場合、分秒は「0000」と記載して差し支えない。 |
まとめ:
✅ N.2.r.4 メッセージ作成の日付=C.1.2 作成の日付
※前回報告より後になるよう(日付や時間を調整)に設定
✅ (後)N.1.5 バッチ伝送の日付>(前)N.2.r.4 メッセージ作成の日付
✅ N.2.r.4 メッセージ作成の日付=C.1.2 作成の日付
※前回報告より後になるよう(日付や時間を調整)に設定
✅ (後)N.1.5 バッチ伝送の日付>(前)N.2.r.4 メッセージ作成の日付


コメント