こちらの記事では、令和2年8月31日
薬生安発0831第4号「医療用医薬品の添付文書等の記載要領の留意事項について」(参考:改正後全文)を例示を用いて説明します。
分かりやすい言葉で説明します。
筆者情報
製薬業界12年以上勤務をしており、今は管理職に就いています。
ベンチャー企業で勤務しており、日々の業務に関する情報や知識を当ブログに掲載しております。
- 解説する通知
- 医療用医薬品の添付文書等の記載要領の留意事項
- 第 1 記載上の一般的留意事項
- 1. 各項目の記載に当たっては、原則として 8 ポイント程度の活字を用い、見 やすくするよう配慮すること。紙面数等の都合により、活字の級数を下げる 場合は、6 ポイント以上とすること。ただし、「3.組成・性状」を除く「1. 警告」から「15.その他の注意」までは、表内及び脚注を除き 8 ポイント以上とすること。
- 2. 様式・仕様は原則として、別紙1を参考に、次のとおりとすること。
- 3. 原則として、明朝体を用いて記載し、漢字、ひらがな及びカタカナは全角、 英数字は半角で記載すること。ただし、項目名等主要な事項の記載に当たっては、ゴシック体を用い他の項目に比較して見やすくすること。また、別に定めがある項目を除き、文字は赤色を使用しないこと。
- 4. 項目名は、別に定めがある場合を除き、平成29年6月8日付け薬生発 0608 第1号厚生労働省医薬・生活衛生局長通知「医療用医薬品の添付文書等の記載要領について」(以下「局長通知」という。)に示すものを用いること。ただし、「4. 効能又は効果」及び「5. 効能又は効果に関連する注意」の項目名における「効能又は効果」を「効能効果」又は「効能・効果」に、「6. 用法及び用量」及び「7. 用法及び用量に関連する注意」の項目名における「用法及び用量」を「用法用量」又は「用法・用量」にそれぞれ代えることは差し支えないこと。
- 5. 項目番号は、局長通知に示すものを用い、下位の項目をつける場合は、第 3 位まで「1.1.1」等と記載すること。更に項目番号が必要な場合には、両括弧 を用い「(1)」等と記載すること。
- 6. 関連する項目を参照先として記載する場合は、項目番号を用いて末尾に 「1.1.1 参照」等と記載すること。
- 7. 他剤との比較データを記載する場合には、原則として、対照医薬品は一般的名称を記載すること。ただし、生物学的同等性試験の結果を記載する場合 には、先発医薬品及び先行バイオ医薬品は販売名を記載すること。
- 8. 生物学的同等性試験の結果を記載する場合は、同等性の評価指標に応じて「16. 薬物動態」、「17. 臨床成績」又は「18. 薬効薬理」に記載すること。
- 第 2 各項目に関する留意事項
- 第 1 記載上の一般的留意事項
解説する通知
令和2年8月31日
薬生安発0831第4号
(参考:改正後全文)
「医療用医薬品の添付文書等の記載要領の留意事項について」(平成29年6月8日付け薬生安発0608第1号)
・添付文書改訂等の安全対策に関連する通知等全てご覧になりたい方はこちらをCHECK!
添付文書関連
医療用医薬品の添付文書等の記載要領の留意事項
第 1 記載上の一般的留意事項
1. 各項目の記載に当たっては、原則として 8 ポイント程度の活字を用い、見 やすくするよう配慮すること。紙面数等の都合により、活字の級数を下げる 場合は、6 ポイント以上とすること。ただし、「3.組成・性状」を除く「1. 警告」から「15.その他の注意」までは、表内及び脚注を除き 8 ポイント以上とすること。

まずは見た目からだにゃ〜
文字:8ポイント(字下げは6ポイント以上)
2. 様式・仕様は原則として、別紙1を参考に、次のとおりとすること。
(1) 仕様
A4 判
4 頁以内を目安とすること
左綴じ代として 1.7cm を確保すること
(2) 様式
「1.警告」を有する医薬品:白色紙の右上縁に赤色の帯を印刷すること
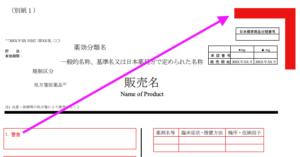
その他の医薬品:白色紙
3. 原則として、明朝体を用いて記載し、漢字、ひらがな及びカタカナは全角、 英数字は半角で記載すること。ただし、項目名等主要な事項の記載に当たっては、ゴシック体を用い他の項目に比較して見やすくすること。また、別に定めがある項目を除き、文字は赤色を使用しないこと。
文字▶︎明朝体かつ全角
英数字▶︎半角
項目名等主要な事項の記載▶︎ゴシック
4. 項目名は、別に定めがある場合を除き、平成29年6月8日付け薬生発 0608 第1号厚生労働省医薬・生活衛生局長通知「医療用医薬品の添付文書等の記載要領について」(以下「局長通知」という。)に示すものを用いること。ただし、「4. 効能又は効果」及び「5. 効能又は効果に関連する注意」の項目名における「効能又は効果」を「効能効果」又は「効能・効果」に、「6. 用法及び用量」及び「7. 用法及び用量に関連する注意」の項目名における「用法及び用量」を「用法用量」又は「用法・用量」にそれぞれ代えることは差し支えないこと。
1. 警告
2. 禁忌(次の患者には投与しないこと)
3. 組成・性状
3.1 組成
3.2 製剤の性状
4. 効能又は効果
5. 効能又は効果に関連する注意
6. 用法及び用量 (用法用量or用法・用量でもOK)
7. 用法及び用量に関連する注意(用法用量に関連する注意or用法・用量に関連する注意でもOK)
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.2 腎機能障害患者
9.3 肝機能障害患者
9.4 生殖能を有する者
9.5 妊婦
9.6 授乳婦
9.7 小児等
9.8 高齢者10. 相互作用
10.1 併用禁忌(併用しないこと)
10.2 併用注意(併用に注意すること)11. 副作用
11.1 重大な副作用
11.2 その他の副作用12. 臨床検査結果に及ぼす影響
13. 過量投与
14. 適用上の注意
15. その他の注意
15.1 臨床使用に基づく情報
15.2 非臨床試験に基づく情報16. 薬物動態
16.1 血中濃度
16.2 吸収
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.7 薬物相互作用
16.8 その他17. 臨床成績
17.1 有効性及び安全性に関する試験
17.2 製造販売後調査等
17.3 その他18. 薬効薬理
18.1 作用機序
19. 有効成分に関する理化学的知見
20. 取扱い上の注意
21. 承認条件
22. 包装
23. 主要文献
24. 文献請求先及び問い合わせ先
25. 保険給付上の注意
26. 製造販売業者等
5. 項目番号は、局長通知に示すものを用い、下位の項目をつける場合は、第 3 位まで「1.1.1」等と記載すること。更に項目番号が必要な場合には、両括弧 を用い「(1)」等と記載すること。
Q&Aより、(1)以降に 1)や①は使用しないこと。 また、「以下の…」に続けて箇条書きで列挙する場合は、「・」(中点)を用いて記載すること。
(記載例)
9.特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 感染症又はその疑いのある患 者
(1)結核の既往歴を有する患者
(2)肝炎ウイルスの感染又は既往を有する患者
9.1.2 以下のような尿素サイクル異常症が疑われる患者
・原因不明の脳症若しくは原因不明 の昏睡の既往歴のある患者
・尿素サイクル異常症又は原因不明 の乳児死亡の家族歴のある患者
6. 関連する項目を参照先として記載する場合は、項目番号を用いて末尾に 「1.1.1 参照」等と記載すること。
(記載例)
9.3.1 肝移植患者
○○等の腎機能を抑制する可能性のある免疫抑制剤が投与されている肝移植患者では, 本剤の投与開始前と投与中に腎機能の観察を十分に行うこと。 肝移植患者を対象とした有効性及び安全性を指標とした臨床試験は実施していない。[7.2、8.1-8.3、16.6.3 参照]
7. 他剤との比較データを記載する場合には、原則として、対照医薬品は一般的名称を記載すること。ただし、生物学的同等性試験の結果を記載する場合 には、先発医薬品及び先行バイオ医薬品は販売名を記載すること。
対照医薬品とは…
対照薬とは、新薬(被験薬)の有効性・安全性を確かめる比較試験の際に被験薬の比較対照として用いられる薬。見た目や味覚など、外見上の特徴が被験薬と同一になるように製剤される。
■対照薬の種類
対照薬として選択される薬には以下の2種類があり、どの薬を対照薬に選ぶかによって比較試験の具体的な名称が変化する。
・実薬
既に販売承認許可が下りている薬。市販薬。
実薬を対照薬に定めた比較試験は、「実薬対照試験」といわれる。
・偽薬(プラセボ)
生理食塩水や乳糖を原料として作られた、薬効成分を一切含んでいない薬。
偽薬を対照薬に定めた比較試験は、「プラセボ対照試験」といわれる。
製薬企業の転職支援 アンサーズより引用
8. 生物学的同等性試験の結果を記載する場合は、同等性の評価指標に応じて「16. 薬物動態」、「17. 臨床成績」又は「18. 薬効薬理」に記載すること。



コメント