こんにちはプログレです。
本日は医薬品の「安全性定期報告」について分かりやすく説明します。
筆者は、製薬業界で12年以上働いており今では製薬会社の管理職についています。
安全性定期報告とは
 新医療用医薬品について製造販売の承認を受けた者は、再審査期間中、当該医薬品の使用の成績等に関する調査(外国で使用されるものであって当該医薬品と成分が同一のもの(以下「成分同一物」という。)がある場合は当該成分同一物に係る調査を含む。また、法第 14 条第 10 項前段の規定に基づき、医薬品の使用の成績等に関する調査を実施している場合には、その内容も含めること。)を行う場合、その結果に基づき、厚生労働大臣に報告すること。
新医療用医薬品について製造販売の承認を受けた者は、再審査期間中、当該医薬品の使用の成績等に関する調査(外国で使用されるものであって当該医薬品と成分が同一のもの(以下「成分同一物」という。)がある場合は当該成分同一物に係る調査を含む。また、法第 14 条第 10 項前段の規定に基づき、医薬品の使用の成績等に関する調査を実施している場合には、その内容も含めること。)を行う場合、その結果に基づき、厚生労働大臣に報告すること。
つまり、、、新医薬品として区分された薬が承認されたら、「一定期間中の調査情報を厚生労働大臣に定期的に提出しなければいけません」と決められています。
データロック、提出頻度及び期日
 基本的に最初のデータロックは、IBD(International Birth Date: 国際誕生日)を基準に考えます。
基本的に最初のデータロックは、IBD(International Birth Date: 国際誕生日)を基準に考えます。
✅ データロック
▶︎ IBDを基準に6ヶ月ごとにデータロックを設定
✅ 提出頻度
▶︎ 初回〜2年間:半年毎
▶︎ それ以降:年1回
✅ 期日
▶︎ 提供資料が日本語:70日
▶︎ 提供資料が日本語以外:3ヵ月
例)
IBD:2019/01/01
日本のDLP:2019/07/01
日本の承認日:2019/11/01
| X回目の提出 | 対象期間 | データロック | 提出期日 |
| 1 | 2019/11/01〜2019/12/31 | 2020/01/01 | 2020/04/01 |
| 2 | 2020/01/01〜2020/06/30 | 2020/07/01 | 2020/10/01 |
| 3 | 2020/07/01〜2020/12/31 | 2021/01/01 | 2021/04/01 |
| 4 | 2021/01/01〜2021/06/30 | 2021/07/01 | 2021/10/01 |
| 5 | 2021/07/01〜2021/12/31 | 2022/01/01 | 2022/04/01 |
| 6 | 2022/01/01〜2022/12/31 | 2023/01/01 | 2023/04/01 |
ワンポイントアドバイス
5回目から年1回でOK
ただ、PEBRERを海外で作成している場合は、IDBに合わせる意味で、半年提出を1回余分にやった方が良いかも
初回提出
 ⬇️FDAで既に承認されている場合のあるある質問です😇
⬇️FDAで既に承認されている場合のあるある質問です😇
Q. 薬価収載されていない又は発売していない等の理由により、安全性定期報告の調査単位期間の満了日までに製造販売後調査等を開始していない場合、どの様な形式・内容で安全性定期報告書を提出すればよいか。
A.承認時までの状況、海外情報あるいは成分同一物の情報を記載した安全性定期報告書を提出すること。その際、別紙様式1-2には、製造販売後調査等の実施の有無によらず、承認時までの主要な臨床試験を全て記載すること。別紙様式2~4に記載すべき情報がない場合は、局長通知の別紙様式第1に、記載すべき情報がない旨及びその理由を記載することで、記載すべき情報がない別紙様式の提出は不要とする。
なお、製造販売後調査等の開始が遅延している場合は、局長通知の別紙様式第
1に、開始遅延の理由及び開始予定時期を記載すること。
安全性定期報告に関する質疑応答集(Q&A)について
https://www.pmda.go.jp/files/000238022.pdf
※Qについて分かりやすく補足
薬価収載:まだ薬の値段が決まっていない
発売していない:承認されて直ぐに発売できないこともあります。

特許切れを考えると早く発売した方が良いのになんで?
例えば、医療機器と合わせて使用する又は他剤併用の場合、医療機器・他剤も決まった適応で承認されなければなりません。
なのでメインとなる薬剤のみならず周辺の準備がしっかり進んでいる必要があります。
そのため、承認取得▶︎薬価収載▶︎発売の流れとなり、期間が空いてしまいます。
各フォームの紹介
「初回提出」でAに(答えとして)書かれた各Formは以下のとおりです。
別紙様式1:新医療用医薬品に関する安全性定期報告書

別紙様式1-2:承認時までの副作用・感染症の発現状況
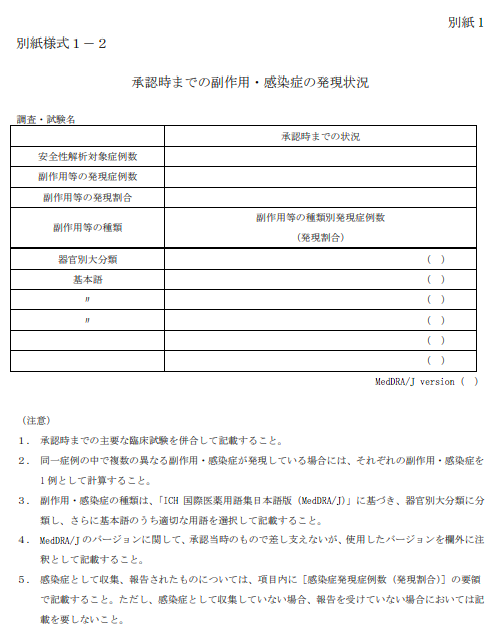
別紙様式2:製造販売後調査等における副作用・感染症の発現状況
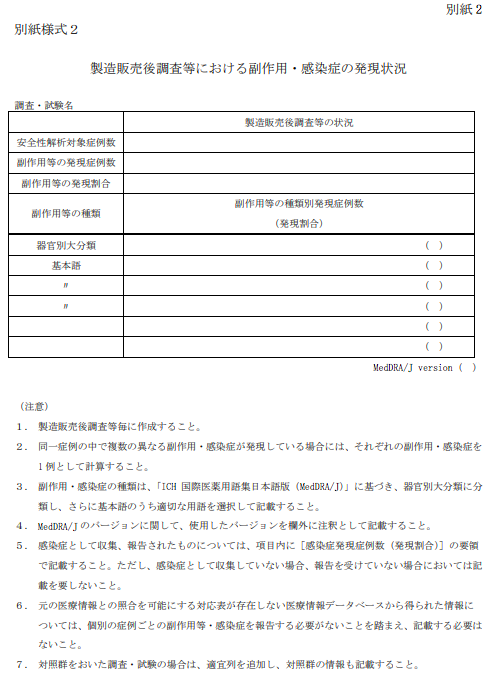
別紙様式3:副作用・感染症症例報告における発現状況
様式ではないのですが、添付資料としてPBRER及び日本の添付文書が求められます。
参照資料
新医療用医薬品に関する安全性定期報告制度について
薬生発0831第5号 令和2年8月31日
https://www.pmda.go.jp/files/000236891.pdf
安全性定期報告に関する質疑応答集(Q&A)について
事 務 連 絡 令和2年12月9日
https://www.pmda.go.jp/files/000238022.pdf
「安全性定期報告書別紙様式及びその記載方法について」の一部改正について
薬生薬審発 1128 第5号 薬 生 安 発 1128 第 4 号
平 成 29 年 11 月 28 日
https://www.pmda.go.jp/files/000221992.pdf



コメント