今はEDC(Electronic Data Capture)システムを使った、詳細調査票が大学病院等大きな施設では多いです。
しかし、まだまだWordベース(紙ベース)の調査票を使っている施設も多いのが事実…
筆者情報
製薬業界12年以上勤務をしており、今は管理職に就いています。
小さな会社なので、守備範囲も広く、毎日新しいことにチャレンジしてながら、フルタイムで働き2歳と4歳の子育てをしています。
この記事、こんな方に届け〜
特に、
- MRさん
- PV、PMSに所属してい日が浅い方
- ご興味がある方(患者さんやそのご家族も含め)
どうかそのような、勉強熱心な方に届くと嬉しいです😊
*もし質問や誤記載等お気づきの点ありましたら、コメントからお気軽に問い合わせてください。
詳細調査票(製薬協モデル)
以下のサイトから入手できます
・PDF版
・Word版
(※画像をクリックすると、サイトに移動します)
詳細調査票(製薬協)モデルを用いて、以下を表形式で説明します。
- 分かりにくい点に番号をつける
- 詳細を説明
施設名/科名、報告者氏名、初回・再調査日時

| 番号 | 項目名 | 詳細説明 |
| 1 | 報告者氏名(記名押印又は署名) | 詳細調査票は全て「医師」が記載。押印や署名は印刷したものに書く |
| 2 | 再調査時 | 再調査時は「追加」か「変更」か分かるように書くこと。何も書かれていなければ「追加」として見なされる。「変更」なら”取り消し線+日付+報告者イニシャル” |
患者背景、原疾患、合併症、既往歴、アレルギー歴及び家族歴、過去の医薬品の副作用歴(今回の副作用を除く)
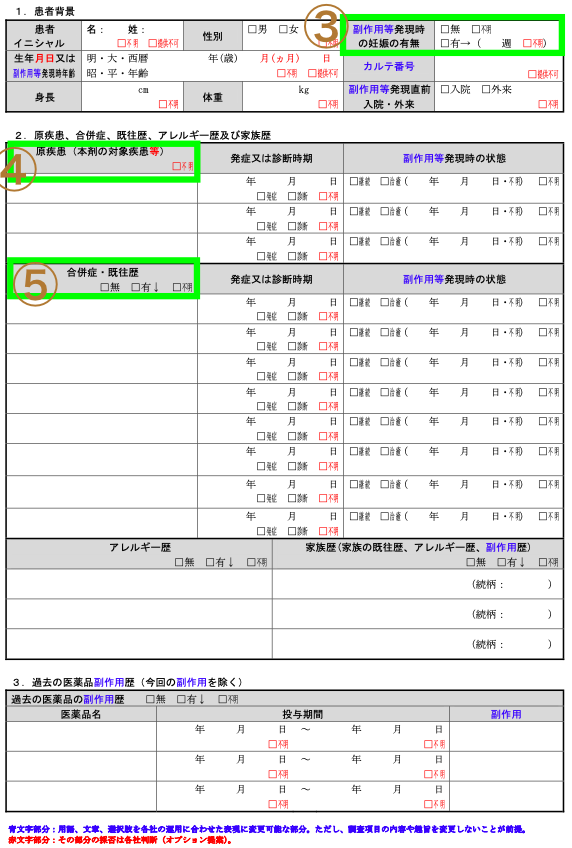
| 番号 | 項目名 | 詳細説明 |
| 3 | 副作用発現時の妊娠の有無 | 患者登録時の妊娠の有無が問われることがある(理由:添付文書で妊婦に対する注意書きがあるから)その場合Special Situationになりえる(例:妊娠時の薬物暴露) |
| 4 | 原疾患(本剤の対象疾患等) | 症状や徴候を含む診断名を。基本的には自社薬添付文書の適応症が書かれる。そうでなければ、Special Situationとなる(例:適応外使用) |
| 5 | 合併症・既往歴 | 報告する事象(AE)と関連すると考えられる、患者さんの合併症や既往歴(喫煙、飲酒含む) |
併用療法(原疾患・合併症に対する医薬品以外の治療)、医薬品投与状況(本剤および併用薬)、被疑薬の再投与

| 番号 | 項目名 | 詳細説明 |
| 6 | 1回投与量 | 薬剤の投与量、単位、剤型、投与経路、投与頻度(例:10mg錠1日1回経口投与) |
| 7 | 再投与の有無と医薬品名 | Q.なぜ再投与の有無が問うのか? A. 再投与後、副作用が再度発現したら、薬と副作用の因果関係が濃厚になる |
副作用・感染症、死亡例の場合の情報
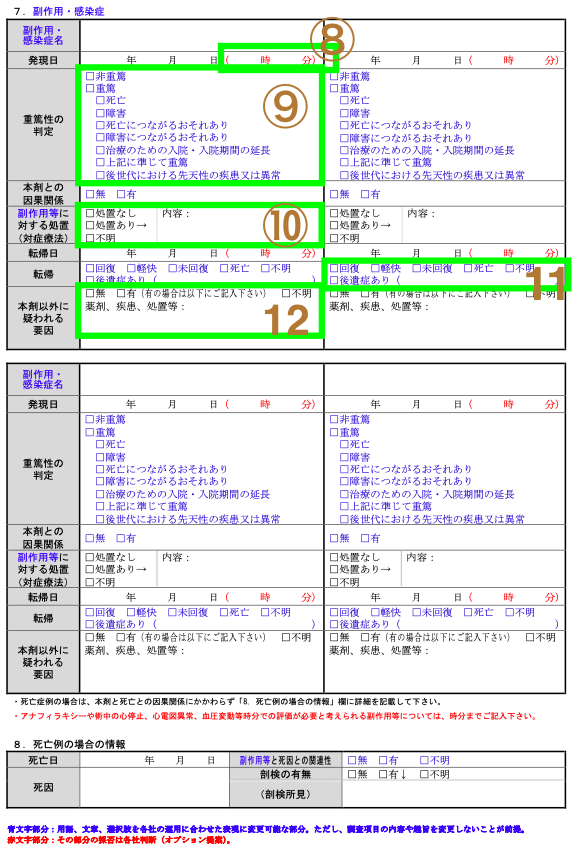
| 番号 | 項目名 | 詳細説明 |
| 8 | 発現日 | 日時まで問われることはない。しかし分けるのであれば書いてもらえるとより有用(例:アナフィラキシーショックなど) |
| 9 | 重篤性の判定 | 「死亡につながるおそれあり」は ⭕️ 患者さんがその事象により死の危険に晒されていたと医師が判断するもの ❌ 仮にもっと重症だったら死に至ってたかもしれない |
| 10 | 副作用等に対する処置(対症療法) | 副作用に対して、薬や手術をした場合 |
| 11 | 転帰 | 「回復」もしくは「死亡」まで追加情報をPV/PMS▶︎MRさんに依頼されます |
| 12 | 本剤以外に疑われる因子 | 原疾患、薬物相互作用、合併症・既往歴、併用薬・併用療法などが考えられます |
副作用等の経過、副作用等に対するご意見

| 番号 | 項目名 | 詳細説明 |
| 13 | 副作用等に対するご意見 | 項目がなかったせいで、
|
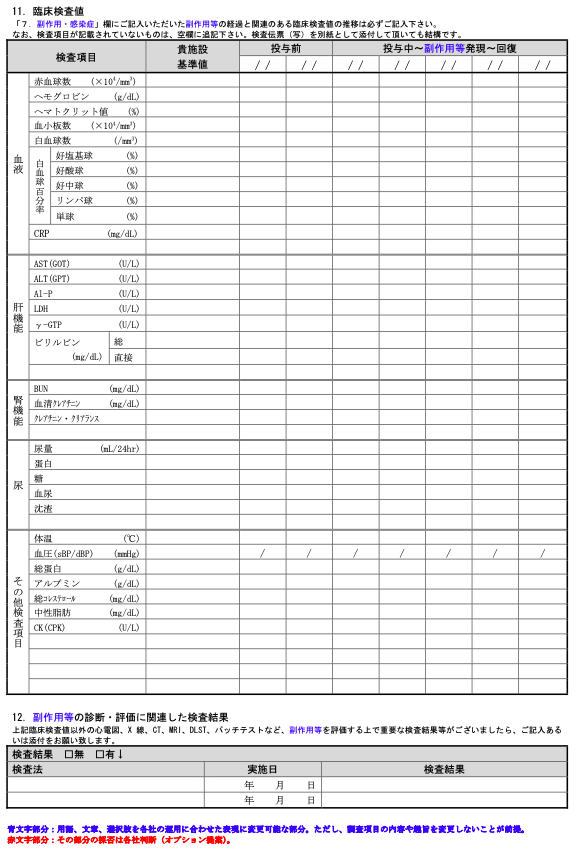
臨床検査値



コメント